揭示促进癌症扩散的生存技能!
来源:中检健康
编辑:中检健康
时间:2019-10-26
癌症从原发性位点扩散到继发部位的过程被称之为癌症转移,这通常是致命性的;发生转移开始的时间依赖于原发位点肿瘤尺寸、阶段和其分化状态,癌症转移需要癌细胞经历一些变化,包括那些促进其获得侵袭性特性的变化等。E-钙黏蛋白(E-cadherin)表达的缺失会促进细胞发生迁移,但该蛋白如何发挥其转移中心调节子的角色,目前研究人员并不清楚;日前,一项刊登在国际杂志Nature上的研究报告中,Padmanaban等人就通过研究发现,E-钙黏蛋白或许就在癌细胞转移方面扮演着关键角色,而这与其对细胞侵袭和迁移的影响似乎并不相同。
图片来源:Padmanaban et al Nature(2019).
E-钙黏蛋白存在于上皮细胞膜上,而上皮细胞是机体表面的屏障,当上皮-间充质转化(EMT,epithelial-to-mesenchymal transition)过程被诱发,E-钙黏蛋白缺失发生时,上皮细胞就会获得间充质细胞的特性,后者具有高度的流动性。EMT通常是由特定的刺激所激活的,比如暴露于信号蛋白TGF-β中等,这一过程通常发生在胚胎发育过程中,其在机体伤口愈合过程中能帮助器官内的正常上皮细胞进行定位,然而,EMT也会被癌症的发育和扩散所拦截。
上皮细胞之间的粘附是由E-钙黏蛋白所介导的,这种粘附会抑制癌症转移的发生,有研究证据表明,转移性的癌细胞通常会表达E-钙黏蛋白以及与上皮细胞命运相关的特殊分子。比如,E-钙黏蛋白就存在于一种被称之为浸润性导管乳腺癌的乳腺癌转移细胞中,如果转移性癌细胞经历了EMT过程并到达一个次要部位时,其随后就会经历一个称之为间充质向上皮过渡的逆转过程,而次级位点细胞中E-钙黏蛋白的存在或许并不一定表明,该蛋白能够帮助转移性细胞在该位点处形成。
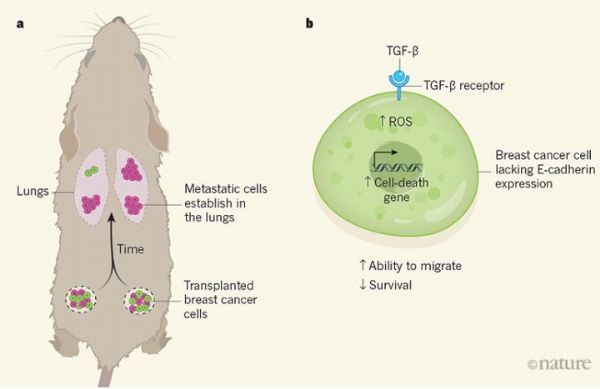
研究者Padmanaban等人对多种类型的浸润性导管乳腺癌小鼠模型进行研究,调查了E-钙黏蛋白在该类癌症中的作用,同时还分析了引入到小鼠模型中的人类癌细胞的特性;研究者对小鼠或人类癌细胞进行工程化改造使得E-钙黏蛋白的表达能被降低或阻断,通过他们还通过监测荧光蛋白的方法来追踪E-钙黏蛋白的表达情况,结果表明,表达E-钙黏蛋白的癌细胞在体外的迁移行为比未表达的癌细胞要少,这与此前的研究结果一致。
当研究者对移植到小鼠机体中的人类癌细胞的行为进行研究时他们发现,在原发性肿瘤位点中,表达E-钙黏蛋白的细胞要比缺乏E-钙黏蛋白的细胞更加常见一些,而从原发性肿瘤位点逃逸的肿瘤细胞(循环肿瘤细胞,CTCs)和转移的肿瘤细胞也是如此。当肿瘤细胞被植入动物的乳腺或将其注射到动物模型血液中,那些表达E-钙黏蛋白的细胞会建立次级位点,而缺乏E-钙黏蛋白的癌细胞则很少会这样做,这让研究人员非常不可思议,因为此前研究人员并未发现E-钙黏蛋白能帮助促进转移性癌细胞生存。
研究者发现,相比表达E-钙黏蛋白的癌细胞而言,缺失该蛋白的癌细胞表达与细胞凋亡相关的基因的水平较高,而且也会表达与压力相关的通路的基因。TGF-β和ROS分子促进这些通路上调,当研究者Padmanaban进行体外和体内试验,利用抑制剂来靶向作用TGF-β、ROS分子或细胞凋亡所需的组分时,他们发现,这种策略能够抵消癌细胞中E-钙黏蛋白缺失的效应,涉及TGF-β和ROS的通路对于诱发浸润性导管乳腺癌细胞的细胞凋亡非常重要,这些癌细胞中会表达较低水平的E-钙黏蛋白。
研究者表示,E-钙黏蛋白能以一种上下依赖性的方式来通过帮助转移性细胞克服TGF-β和ROS分子所介导的压力,从而促进肿瘤进展和转移,而E-钙黏蛋白的缺失则会通过影响细胞的生存并损伤肿瘤的建立和次级位点细胞的增殖,进而降低细胞的转移潜能,因此,对于浸润性导管乳腺癌的转移而言,E-钙黏蛋白的促生存作用已经超过了其缺失促进癌症侵袭性的优势。
未来研究人员想通过研究确定来自原发性肿瘤、CTCs和转移性位点中的细胞编码E-钙黏蛋白的基因的表达是否会存在差异,在EMT过程中,细胞被认为会经历不同的状态,但在进行EMT过程中的肿瘤所发生的细胞命运转变目前仍然是一个谜,而且这依赖于肿瘤类型的不同。目前研究人员并不清楚,表达E-钙黏蛋白的浸润性导管乳腺癌细胞(即使在低水平下)是否处于EMT状态,或成为并不进行EMT过程的特殊细胞系。单细胞RNA测序还能够揭示在原发性肿瘤或转移性细胞中是否存在不同的克隆群,这些细胞并没有通过EMT状态过渡的迹象。
集体性传播,即不同类型的细胞聚集在一起,其能增强肿瘤在远端位点定植的能力,如果这种肿瘤的相互依赖性发生在具有高水平E-钙黏蛋白的压力耐受性细胞和具有低水平E-钙黏蛋白的侵袭性细胞之间,那么当利用诸如化疗等手段治疗癌症患者后,集体传播有助于帮助增加癌细胞的转移,从而导致细胞压力出现;研究肿瘤进化的模式,并分析疗法失败及癌细胞生存途径的机制(特别是耐受性癌细胞)或有望帮助研究人员开发新型癌症疗法。当然了,E-钙黏蛋白的表达是否在不同类型肿瘤的生存或不同肿瘤的转移过程中扮演关键角色,还有待于研究者进一步探索。
影响肿瘤生长的一般因素能为癌细胞转移过程中细胞适应的发生提供线索,然而,由于特定类型肿瘤的遗传背景会影响癌症发生转移,研究者还需要进行更为深入的研究才能阐明。研究者Padmanaban等人揭示了E-钙黏蛋白为何对于浸润性导管乳腺癌的转移非常必要,而其它类型癌症或许会利用一种可替换的机制来控制压力,其可能会产生不同的肿瘤弱点来帮助研究人员开发新型癌症疗法。
预防癌症转移比治疗转移更好,阐明E-钙黏蛋白的表达时如何稳定的或能帮助解释癌细胞在转移过程中的弱点,开发个体化疗法来治疗或预防转移或许是癌症研究的下一个目标,目前研究人员正在努力朝这方面努力前行。(生物谷Bioon.com)
参考资料:
【1】Veena Padmanaban, Ilona Krol, Yasir Suhail, et al. E-cadherin is required for metastasis in multiple models of breast cancer, Nature (2019) doi:10.1038/s41586-019-1526-3
【2】Pastushenko I, Blanpain C. EMT Transition States during Tumor Progression and Metastasis. Trends Cell Biol. 2019 Mar;29(3):212-226. doi: 10.1016/j.tcb.2018.12.001
【3】Aiello NM, Kang Y. Context-dependent EMT programs in cancer metastasis. J Exp Med. 2019 May 6;216(5):1016-1026. doi: 10.1084/jem.20181827
【4】Haensel D, Dai X. Epithelial-to-mesenchymal transition in cutaneous wound healing: Where we are and where we are heading. Dev Dyn. 2018 Mar;247(3):473-480. doi: 10.1002/dvdy.24561
【5】Kennecke H, Yerushalmi R, Woods R, et al. Metastatic behavior of breast cancer subtypes. J Clin Oncol. 2010 Jul 10;28(20):3271-7. doi: 10.1200/JCO.2009.25.9820
【6】Roger R. Gomis. Survival skills ensure that cancer spreads, Nature 573, 353-354 (2019)
doi:10.1038/d41586-019-02570-z
(声明:本网站部分图片、文章来源于网络,本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们联系,我们将及时删除)
