Cell:背靠背 | 相分离促进紧密连接形成的机制
来源:中检健康
编辑:中检健康
时间:2019-11-15
细胞连接(cell junction) 是指相邻细胞之间、细胞与细胞外基质之间在质膜接触区域特化形成的连接结构。细胞连接在加强细胞间的机械联系,维持组织结构的完整性和协调不同细胞功能方面起着重要的作用。细胞连接可分为紧密连接(tight junction)、锚定连接和通讯连接三种类型。其中紧密连接广泛存在于上皮或内皮细胞间连接的最顶端,由闭合蛋白(occludin)、密封蛋白(claudin)、连接粘附分子(JAM)、ZO蛋白等蛋白组成,其中ZO蛋白属于细胞内的接头蛋白将肌动蛋白纤维以及闭合蛋白(occludin)、密封蛋白(claudin)、连接粘附分子胞内区连接起来。上皮细胞通过紧密连接形成整体,防止物质的自由扩散,维持自身的极性。大量的研究已经阐明了紧密连接的主要构成蛋白以及其相关的调节机制。
但是,类似于神经生物学中的PSD(postsynaptic density)结构,作为一个开放式的亚细胞分区,含有如此高浓度蛋白的PSD是如何形成的,形成紧密连接的结构中的ZO等蛋白是如何高度聚集在紧密连接部位,而不会扩散到细胞内部其他区域是这一领域尚未解释的问题。近些年,香港科技大学张明杰教授课题组2016年在Cell上报道了PSD中高丰度表达的两个蛋白PSD-95与SynGAP在体外较高浓度下可以发生液-液相分离,为神经科学领域长期存在的关于PSD形成的问题提供了一个可能的答案 (Cell丨张明杰组破解突触的建立与可塑性调节的机制——温文玉解读)。那么是否紧密连接胞内区也以同样的方式通过一些蛋白的相分离完成这些蛋白的有序组织和高度聚集?
2019年10月31日,来自Max Planck Institute of Molecular Cell Biology and Genetics(即首次报道细胞内相分离现象的Hyman Lab所在的机构)的Alf Honigmann课题组在Cell杂志发表了题为Phase Separation of Zonula Occludens ProteinsDrives Formation of Tight Junctions的文章,阐明了ZO 蛋白通过相分离促进紧密连接的形成,为这一领域提供了新的解释。
之前的研究结果表明:
1. ZO1和ZO2蛋白对于形成紧密连接是非常重要的。
2. 紧密连接结构中的ZO1蛋白与细胞质中的ZO1处于高度动态交换中。
3. ZO蛋白结构与PSD95等分子相似,具有多价的相互作用。
这些结果都提示了ZO1可能会形成相分离。
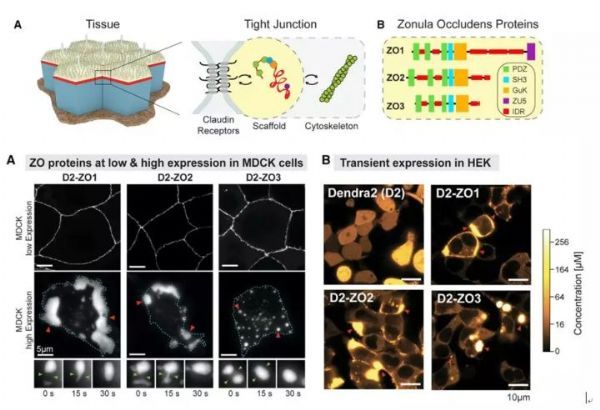
作者首先对紧密连接部位的ZO1和ZO2蛋白的浓度进行了测定,作者发现ZO1和ZO2在紧密连接位点的浓度都显着高于在胞质中的浓度。作者进一步使用FRAP实验证实了紧密连接处的ZO1和ZO2蛋白与胞质中的这两个蛋白处于高度动态交换的过程中。
为了进一步证明这两个蛋白是否确实能够发生相分离,作者在细胞中过表达了ZO1,ZO2和ZO3蛋白,作者发现,当表达量较低时候,外源表达的蛋白很好地定位到了紧密连接位点,当表达量较高时,在非紧密连接的位点这些蛋白也会高度聚集形成非常明亮的Foci,这些foci能够相互融合、分离,显示出了典型的液滴的特征。
这一结果提示了ZO蛋白具有能够发生相分离的特点,也证实了ZO蛋白在超过一定的浓度后就会发生相分离,提示了细胞内存在一个主动将ZO蛋白运输到紧密连接部位的机制(后面会讨论)。作者使用Latrunculin-A抑制actin的聚合后发现,f-actin与ZO蛋白形成了串珠状的结构,并且在“珠子”处高度富集。将Latrunculin-A去除后,又恢复了原来的细胞膜环状结构。这些实验结果说明了ZO蛋白的相分离对于紧密连接的形成的最初阶段可能具有重要作用,且该过程是被精细调控的。
作者进一步在体外研究ZO蛋白是否能够发生相分离,同时研究其翻译后修饰,特别是磷酸化修饰对于其相分离性质的影响。作者在高盐离子浓度下纯化了高浓度的ZO蛋白,将盐离子浓度降低后,ZO蛋白自发形成了droplet结构,并且这种结构依赖于蛋白浓度,盐离子浓度,可以相互融合,以及荧光漂白后能够恢复。
作者进一步证实了ZO蛋白的磷酸化修饰可以抑制ZO蛋白的相分离,这些实验结果说明了ZO蛋白在体合适的环境中外可以发生相分离,并且这种相分离现象受到翻译后的磷酸化修饰的调控。作者进一步mapping了ZO蛋白中介导相分离发生的domain,发现ZO蛋白中间的PSG(PDZ3-SH3-GuK)domain 可以发生相分离而其他的domain不能发生相分离,作者还发现了除了PSG domain,其他区域对于全长的ZO蛋白的相分离也有一定的促进作用。
ZO蛋白被证实可以招募和有序组织其他的蛋白到紧密连接位点,因此作者推测可能是发生了相分离的ZO蛋白对于其他紧密连接相关蛋白具有一定的选择性,作者通过体内以及体内的实验证实了ZO蛋白通过相分离形成的droplets对于这些蛋白具有选择性,并不是所有的紧密连接相关蛋白都能进入“ZO droplet”,比如JAM-A。
因此,通过上述实验,证实了ZO蛋白可以通过相分离招募以及高度富集一些紧密连接相关的蛋白到相应的位点,完成紧密连接的有序组织以及一些细胞信号转导过程。
ZO蛋白的相分离是否真的对于紧密连接的形成具有重要的调控作用?之前的一系列的研究已经表明,ZO蛋白介导相分离的PSG结构域的很多突变体能够显着抑制紧密连接的形成,但是这一结构与本身就介导了ZO蛋白与其他的紧密连接相关蛋白的相互作用,这一抑制作用是否是通过相分离介导的无法直接有效的说明。因此作者将关注点聚集在了ZO蛋白的U6结构域上,之前的研究表明该结构域不与任何的紧密连接相关蛋白结合,但是可以调控细胞的紧密连接,无U6结构与的ZO蛋白能够增加紧密连接的组装。
作者利用体内的实验证明ZO蛋白的C端的截断体(保留了U6结构域),能够抑制ZO蛋白的在细胞内的相分离现象。但是如果将U6结构域与C端一起截断后,ZO蛋白的相分离现象显着增强,也就是说,U6结构域抑制了ZO蛋白的相分离现象。另外的体外实验以及体内实验证实了ZO蛋白的U6结构域以及C段结构域虽然不直接参与相分离的发生,但是能够调控ZO蛋白的相分离,U6可以抑制ZO蛋白的相分离,而C端结构域可以增强相分离(可能通过releasing U6 inhibition)。
因此,作者将利用这些突变体来研究ZO蛋白的相分离现象对于紧密连接的作用,作者首先将细胞内的ZO蛋白敲除,回转各个突变体,用于研究ZO蛋白相分离对于紧密连接的作用。作者发现,全长的WT的ZO 蛋白能够很好的RESCUE由于ZO敲除导致的紧密连接形成的障碍,而C端截断体(不能形成相分离)不能RESCUE,而U6以及C端同时截断的可以发生相分离的截断体可以在一定程度上恢复,另外,只截断U6 结构域的截断体可以显着地RESCUE相应的表型。作者还通过体外的实验证实了ZO蛋白的相分离对于紧密连接的重要性。
因此,作者通过多种实验,证明了ZO蛋白相分离对于细胞的紧密连接的形成具有重要的作用。
综上,作者发现了ZO蛋白可以通过类似PSD(postsynaptic density)结构中的PSD95等蛋白相似的机制(多价的相互作用)通过相分离形成与膜相互作用的区室化结构,形成相分离后的ZO蛋白可以选择性地募集另外的一些紧密连接相关蛋白,从而促进紧密连接的形成。(生物谷Bioon.com)
(声明:本网站部分图片、文章来源于网络,本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们联系,我们将及时删除)
