『解读』Nat Neurosci 人脑动脉粥样硬化和阿尔茨海默症的共享蛋白质组效应
来源:中检健康
编辑:中检健康
时间:2020-06-04
大脑动脉粥样硬化(cerebral atherosclerosis,下文简称CA)是指脑动脉硬化后,因脑部多发性梗塞、软化、坏死和萎缩引起神经衰弱综合征、动脉硬化性痴呆、假性延髓麻痹等慢性脑病【1】。CA可引起短暂性脑缺血发作、脑卒中等急性脑循环障碍以及慢性脑缺血症状【1】。
CA患者的脑大动脉壁上堆积有胆固醇斑块,且从动脉壁增厚到管腔狭窄的变化可以反映CA的严重程度,并导致血流和代谢的减少【1】。此外,随着年龄的增长、以及如高脂血症,高血压,糖尿病和吸烟等血管危险因素的存在,CA的患病率会增加【1】。
由此,我们可以大胆猜想CA与和阿尔茨海默症(AD)之间是否也存在着某种潜在的因果联系?一些研究也提示了这种关系:CA存在于7%的无症状的中年个体和82%的80岁以上老年个体【2】;CA(包括CA的结果)是与AD发生和进展有关的最早的变化之一【3-4】;尤其是,如果存在CA,那么患有AD和血管性痴呆的风险分别高达3倍、9倍【5-6】。然而,这些研究尽管提示了CA与AD之间的潜在关系,但是,CA对人类大脑的分子效应,以及这些分子如何导致痴呆的?相关研究还十分有限。
美国埃默里大学医学院的Aliza P. Wingo 博士、Nicholas T. Seyfried 博士、Allan I. Levey教授、以及Thomas S. Wingo 教授等人强强联合,旨在证据性地揭示大脑动脉粥样硬化和阿尔茨海默症之间的联系。研究成功发现了多个CA和AD共有的蛋白质,进一步提示了CA与AD之间的潜在因果关系。相关成果已于2020年5月18以Shared proteomic effects of cerebral atherosclerosis and Alzheimer’s disease on the human brain为题在线发表于Nature Neuroscience。
CA患者的脑大动脉壁上堆积有胆固醇斑块,且从动脉壁增厚到管腔狭窄的变化可以反映CA的严重程度,并导致血流和代谢的减少【1】。此外,随着年龄的增长、以及如高脂血症,高血压,糖尿病和吸烟等血管危险因素的存在,CA的患病率会增加【1】。
由此,我们可以大胆猜想CA与和阿尔茨海默症(AD)之间是否也存在着某种潜在的因果联系?一些研究也提示了这种关系:CA存在于7%的无症状的中年个体和82%的80岁以上老年个体【2】;CA(包括CA的结果)是与AD发生和进展有关的最早的变化之一【3-4】;尤其是,如果存在CA,那么患有AD和血管性痴呆的风险分别高达3倍、9倍【5-6】。然而,这些研究尽管提示了CA与AD之间的潜在关系,但是,CA对人类大脑的分子效应,以及这些分子如何导致痴呆的?相关研究还十分有限。
美国埃默里大学医学院的Aliza P. Wingo 博士、Nicholas T. Seyfried 博士、Allan I. Levey教授、以及Thomas S. Wingo 教授等人强强联合,旨在证据性地揭示大脑动脉粥样硬化和阿尔茨海默症之间的联系。研究成功发现了多个CA和AD共有的蛋白质,进一步提示了CA与AD之间的潜在因果关系。相关成果已于2020年5月18以Shared proteomic effects of cerebral atherosclerosis and Alzheimer’s disease on the human brain为题在线发表于Nature Neuroscience。

首先,为了鉴定与CA相关的大脑蛋白质组的变化。Aliza Wingo (文章一作)等人对438个大脑的背外侧前额叶皮层样本进行了全蛋白质组关联分析(PWAS),并对CA及其他8种年龄相关性脑病理进行了详细的神经病理学的评估,进而鉴定CA相关的标志性蛋白质。这8种病理包括:β-淀粉样蛋白(Aβ)、神经原纤维缠结、大梗死、微梗死、大脑淀粉样血管病、TDP-43蛋白、路易氏小体、以及海马硬化。

图1 CA和AD的差异蛋白表达
(图片引自: Aliza P. Wingo, et al., Nat. Neurosci. 2020)
PWAS结果表明,114种蛋白质在CA中有差异表达(P < 0.05)(图1)。其中,有32种CA高丰度蛋白贡献于少突细胞细胞特异性标记物、以及少突细胞的分化、发育和再髓鞘化,而剩余的82种CA低丰度蛋白则富参与RNA剪接和信使RNA(mRNA)加工(图2)。
我们已从背景知识知悉,糖尿病,高血压和吸烟等是CA的诱发因子,而且CA会导致梗死(即CA的结果)。所以,接下来,作者探究了这些CA相关蛋白是否对血管危险因素或梗死具有敏感性。分析却表明,上述这些CA蛋白的改变与梗死和血管危险因素之间不存这种敏感性关系。
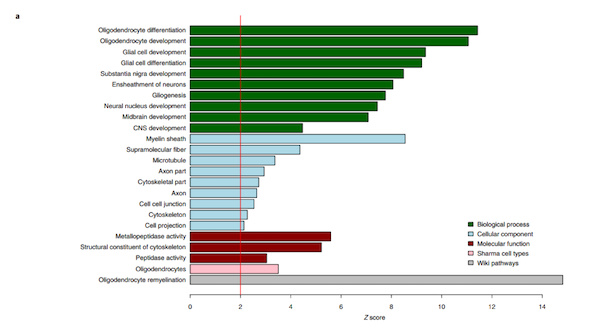
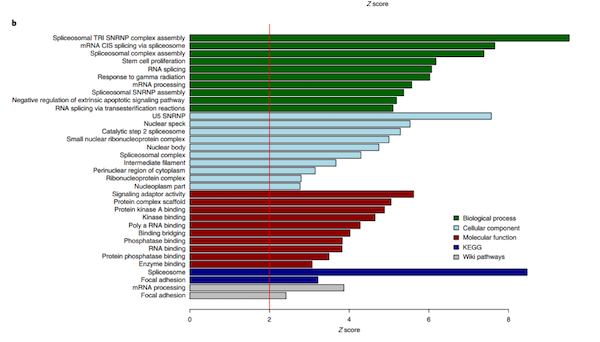
图2a-b CA相关蛋白的富集分析
(图片引自: Aliza P. Wingo, et al., Nat. Neurosci. 2020)
进一步地,作者采用蛋白共表达网络分析,共鉴定了31个蛋白共表达模块(图3a)。其中,与CA相关的5个模块(即模块3、7、9、15和17)不同于其他8个病理特征(P < 0.05),且属于CA低丰度蛋白(图3a);模块3和17为少突细胞细胞类型特异性蛋白,7和15两个模块为神经元特异性标记,模块15则为星形细胞特异性标记(图3b);此外,模块3、9、17参与突触的信号传递、调控以及可塑性;而模块7和15富集于mRNA的剪切与加工(图3c)。
随后,作者也进行了验证实验,正如前述结果,CA与少突胶质细胞的分化、发育和重髓鞘化之间的确具有强相关性,且整体数据具有良好的可重复性。
因此,上述整体结果表明:CA与少突细胞的分化、发育和再髓鞘化相关性最强;与神经元和星形胶质细胞的RNA剪接和mRNA加工的相关性较弱,而与突触的信号传递、调节和可塑性的相关性更弱;与其他8种病理则无相关性。即这些结果确定了与CA相关的大脑蛋白质组的变化。
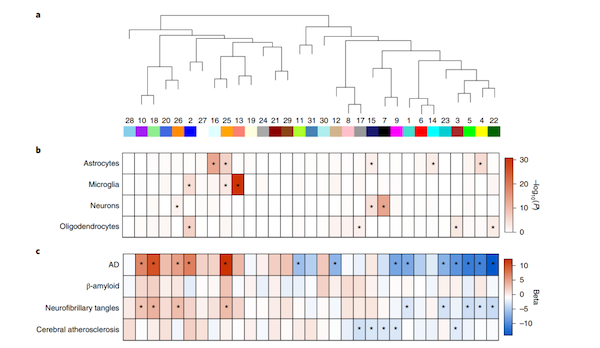
图3 脑细胞类型、以及临床和神经病理结果的蛋白共表达网络分析
(图片引自: Aliza P. Wingo, et al., Nat. Neurosci. 2020)
难么,CA和AD的到底是否具有共同的分子过程呢?于是,作者又对AD及AD标志物Aβ和神经缠结进行了PWAS和蛋白共表达网络分析(图1b、图3c)。
首先,在PWAS分析中,作者鉴定了23种仅AD和CA的共享蛋白(P<0.05),而且这些蛋白在AD和CA中都有较高丰度或较低丰度(图1c)。这进一步支持了CA对认知有不利影响的观点。其次,在对这23种蛋白的共表达分析中,发现有48%为模块核心蛋白(图2-3)。特别地,有7种蛋白富集于模块2核心,且在CA中具有较高的丰度,并贡献于髓鞘的形成和少突细胞细胞的特定标记(图2-3)。此外,结果分析表明,模块3和9仅与AD和CA有较好的关联性,且这两个模块在CA和AD具有较低的丰富度,模块3贡献于突触的调控和少突细胞细胞的特异性标记物,模块9则参与突触的信号传递和其可塑性(图2-3)。
这部分结果则提示,CA可能通过减少突触的信号传递、调节和可塑性,并通过增加大脑灰质中的髓鞘形成,从而影响了AD,包括引起和(或)加速了AD。蛋白质物理相互作用和细胞共定位的验证实验也进一步加强这些结果的可信度。
然而,值得注意的是,这部分实验中,作者没有观察到CA与Aβ、或与神经缠结之间的任何统计学相关性,这暗示了CA影响AD是独立于Aβ和缠结的。这一结果也与早期研究相一致:血管病理影响认知下降是独立于Aβ和tau病理的,且充当“添加剂”的角色【7-8】。
最后,作者想进一步知道,在这些CA和AD的共享蛋白中,有哪些蛋白更值得引起我们的关注?之前的一些研究已表明,NEFL和NEFM蛋白是神经元必不可少的结构支架蛋白,在许多病理过程中会被释放到脑脊液中,进而导致轴突损伤【9】;而且脑脊液和血液中的NEFL水平与AD的进展和诊断之间也存在一定的相关性【10-11】。因此,研究者探究了NEFL和NEFM蛋白水平的改变是否对CA有特异性(图1)。
结果表明,NEFL和 NEFM两种蛋白只与CA相关,与Aβ、神经原纤维缠结、大梗死、微梗死、大脑淀粉样血管病、TDP-43、路易氏小体、以及海马硬化等8种脑病理则无相关性。而且,从轻度认知障碍到AD的这一认知恶化过程中,较对照组,NEFL和NEFM的水平呈阶梯式增加。然而,当用回归模型进行验证时,发现NEFL和NEFM两种蛋白与AD之间的关联不再那么显著,这暗示了CA在某种程度上介导了NEFL和NEFM与AD之间的关联(图1-3)。
最后的这部分数据表明,NEFL和NEFM可能是通过CA从而导致了AD。但仍需要进一步的研究来阐明这种关联的潜在生物学机制。
总的来说,这项工作鉴定了与大脑动脉粥样硬化相关的一组蛋白,并且这些蛋白AD有一定的相关性,进而表明CA和AD两者有共同的机制,为进一步阐明两者之间的潜在因果关系提供了有力证据。同时,研究也提示了CA标志物或许能作为AD早期的诊断依据。
原文链接:https://doi.org/10.1038/s41593-020-0635-5
参考文献:
【1】Qureshi, A. I. & Caplan, L. R. Intracranial atherosclerosis. Lancet 383, 984–998 (2014).
【2】Roher, A. E. et al. Intracranial atherosclerosis as a contributing factor to Alzheimer’s disease dementia. Alzheimer’s Dement. 7, 436–444 (2011).
【3】Zlokovic, B. V. Neurovascular pathways to neurodegeneration in Alzheimer’s disease and other disorders. Nat. Rev. Neurosci. 12, 723–738 (2011).
【4】Sweeney, M. D. et al. Vascular dysfunction—the disregarded partner of Alzheimer’s disease. Alzheimer’s Dement. 15, 158–167 (2019).
【5】 Beach, T. G. et al. Circle of Willis atherosclerosis: association with Alzheimer’s disease, neuritic plaques and neurofibrillary tangles.
Acta Neuropathol. 113, 13–21 (2007).
【6】Arvanitakis, Z., Capuano, A. W., Leurgans, S. E., Bennett, D. A. & Schneider, J. A. Relation of cerebral vessel disease to Alzheimer’s disease dementia and cognitive function in elderly people: a cross-sectional study. Lancet Neurol. 15, 934–943 (2016).
【7】Gottesman, R. F. et al. Association of intracranial atherosclerotic disease with brain β-amyloid deposition: secondary analysis of the ARIC study. JAMA Neurol. 77, 350–357 (2020).
【8】Gustavsson, A. M. et al. Midlife Atherosclerosis and development of Alzheimer or vascular dementia. Ann. Neurol. 87, 52–62 (2020).
【9】Khalil, M. et al. Neurofilaments as biomarkers in neurological disorders. Nat. Rev. Neurol. 14, 577–589 (2018).
【10】17. Zetterberg, H. et al. Association of cerebrospinal fluid neurofilament light concentration with Alzheimer disease progression. JAMA Neurol. 73, 60–67 (2016).
【11】Preische, O. et al. Serum neurofilament dynamics predicts neurodegeneration and clinical progression in presymptomatic Alzheimer’s disease. Nat. Med. 25, 277–283 (2019)..
文章来源:神经学术 王思珍
(声明:本网站部分图片、文章来源于网络,本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们联系,我们将及时删除)
