Nature Communication 全基因组测序探究结直肠癌肝转移机制
来源:中检健康
编辑:中检健康
时间:2019-04-25
研究背景
继发性肝癌又称转移性肝癌(liver metastases, LM),是指人体其他部位的恶性肿瘤通过血液或淋巴系统转移至肝脏的肿瘤。大部分LM是从胃肠道肿瘤转移所致,其中结直肠癌转移的比例最大(约50% ),还有部分来自胃癌(5-9%),胃食管癌(1-2%),胰腺导管腺癌(14%),胰腺癌和肠道神经内分泌肿瘤(1%),胆道癌(5-10%)等恶性肿瘤的转移。另外,还有少部分非胃肠道肿瘤也会导致 LM,比如乳腺癌(< 1-2%),肺癌(12-20%),肾癌(1-2%),黑色素瘤(< 1%)等[1,2]。
结直肠癌肝转移(CRCLM)具有较高的发病率和死亡率,约15-25%的结直肠癌患者在确诊时同时伴有肝转移,另有 15%~25% 的病人将在行结直肠癌原发灶根治术后发生肝转移,其中绝大多数 (80%~90%) 的肝转移灶无法获得根治性切除。发生肝转移但没有经过治疗的患者中位生存期仅为6.9%,肝转移灶无法切除的患者5年生存率低于5%,而可行根治切除术患者的中位生存期mOS为35个月,5年存活率为30-57%。因此,探究结直肠肝转移的诱因和分子机制,对于CRCLM的早诊早治、提升CRCLM患者的生存期具有重要意义[3]。
下面分享一篇2018年发表在Nature Communication上的文章,该研究在全基因组层面综合探究了结直肠癌转移尤其是肝转移的分子机制,为结直肠癌肝转移的治疗决策提供理论基础[4]。
文章信息
文章题目:Whole genome sequencing puts forward hypotheses on metastasis evolution and therapy in colorectal cancer.4
杂志名称:Nature Communication
发布日期:2018.11.14
结果解读
肿瘤转移是导致癌症死亡和产生治疗耐药的主要原因,目前大多数结直肠癌转移的研究集中在晚期转移患者与早期非转移患者的基因差异,较少关注转移灶组织。而关于转移灶与原发灶的研究则主要关注部分蛋白编码基因,全基因组水平的研究较少,样本量也有限,这对于深入探究肿瘤的转移机制和治疗决策作用有限。
因此,本研究利用WGS技术分析了12例没有遗传病史的结直肠癌患者的原发灶与转移灶之间的基因组差异(其中11例为肝转移,1例为肺转移),发现了转移灶特有的突变特征,为阐明结直肠癌的转移和进化机制以及癌症治疗决策提供了科学依据。表1和表2分别展示了该研究中患者的ID、年龄、性别、病理诊断、组织学、转移灶位置、治疗史、肿瘤纯度等临床信息。
继发性肝癌又称转移性肝癌(liver metastases, LM),是指人体其他部位的恶性肿瘤通过血液或淋巴系统转移至肝脏的肿瘤。大部分LM是从胃肠道肿瘤转移所致,其中结直肠癌转移的比例最大(约50% ),还有部分来自胃癌(5-9%),胃食管癌(1-2%),胰腺导管腺癌(14%),胰腺癌和肠道神经内分泌肿瘤(1%),胆道癌(5-10%)等恶性肿瘤的转移。另外,还有少部分非胃肠道肿瘤也会导致 LM,比如乳腺癌(< 1-2%),肺癌(12-20%),肾癌(1-2%),黑色素瘤(< 1%)等[1,2]。
结直肠癌肝转移(CRCLM)具有较高的发病率和死亡率,约15-25%的结直肠癌患者在确诊时同时伴有肝转移,另有 15%~25% 的病人将在行结直肠癌原发灶根治术后发生肝转移,其中绝大多数 (80%~90%) 的肝转移灶无法获得根治性切除。发生肝转移但没有经过治疗的患者中位生存期仅为6.9%,肝转移灶无法切除的患者5年生存率低于5%,而可行根治切除术患者的中位生存期mOS为35个月,5年存活率为30-57%。因此,探究结直肠肝转移的诱因和分子机制,对于CRCLM的早诊早治、提升CRCLM患者的生存期具有重要意义[3]。
下面分享一篇2018年发表在Nature Communication上的文章,该研究在全基因组层面综合探究了结直肠癌转移尤其是肝转移的分子机制,为结直肠癌肝转移的治疗决策提供理论基础[4]。
文章信息
文章题目:Whole genome sequencing puts forward hypotheses on metastasis evolution and therapy in colorectal cancer.4
杂志名称:Nature Communication
发布日期:2018.11.14
结果解读
肿瘤转移是导致癌症死亡和产生治疗耐药的主要原因,目前大多数结直肠癌转移的研究集中在晚期转移患者与早期非转移患者的基因差异,较少关注转移灶组织。而关于转移灶与原发灶的研究则主要关注部分蛋白编码基因,全基因组水平的研究较少,样本量也有限,这对于深入探究肿瘤的转移机制和治疗决策作用有限。
因此,本研究利用WGS技术分析了12例没有遗传病史的结直肠癌患者的原发灶与转移灶之间的基因组差异(其中11例为肝转移,1例为肺转移),发现了转移灶特有的突变特征,为阐明结直肠癌的转移和进化机制以及癌症治疗决策提供了科学依据。表1和表2分别展示了该研究中患者的ID、年龄、性别、病理诊断、组织学、转移灶位置、治疗史、肿瘤纯度等临床信息。

肿瘤及其转移灶的单位点突变特征
在12个患者的原发灶和转移灶中分别鉴定出 10468个(5773-16934个)和11475个(4774-17189)SNV事件,其中原发灶和转移灶共有的SNV占65%,原发灶特有的SNV占15%(1-29%),转移灶特有的SNV占19%(3-42%),这表明在转移灶肿瘤细胞从主克隆进化分离出来后,发生了更多的突变。
图1展示了结直肠癌及其转移灶的高频突变基因,可以看出在高纯度肿瘤配对样本中(指原发和转移配对样本),除了CRC-010的TP53基因仅在转移灶样本中发生突变以外,其他驱动基因均在原发灶与转移灶中同时发生突变。此外,研究者找到一个编码激酶锚定蛋白的高频突变基因ARHGEF33,它是一个鸟嘌呤核苷酸交换因子(GNEF)能够促进KRAS, SPHK等GTPase的激活,从而促进于肿瘤相关的信号通路的激活。
在12个患者的原发灶和转移灶中分别鉴定出 10468个(5773-16934个)和11475个(4774-17189)SNV事件,其中原发灶和转移灶共有的SNV占65%,原发灶特有的SNV占15%(1-29%),转移灶特有的SNV占19%(3-42%),这表明在转移灶肿瘤细胞从主克隆进化分离出来后,发生了更多的突变。
图1展示了结直肠癌及其转移灶的高频突变基因,可以看出在高纯度肿瘤配对样本中(指原发和转移配对样本),除了CRC-010的TP53基因仅在转移灶样本中发生突变以外,其他驱动基因均在原发灶与转移灶中同时发生突变。此外,研究者找到一个编码激酶锚定蛋白的高频突变基因ARHGEF33,它是一个鸟嘌呤核苷酸交换因子(GNEF)能够促进KRAS, SPHK等GTPase的激活,从而促进于肿瘤相关的信号通路的激活。

另一方面,研究者在原发灶和转移灶中发现了之前未报道过的高频非蛋白编码基因,包括:AC010091.1, CTD-2292P10.4, RP11-594N15.3和SNHG14,见图2。AC010091.1与钙黏蛋白FAT4具有同源性,能负调控Wnt信号通路,在胃癌中敲除该基因可导致上皮细胞间充质转化(EMT),获得迁移和侵袭能力。之前有研究表明SNHG14可以与具有抑癌作用的 miR-145-5p结合。非编码RNA RP11-421L10.1在转移灶中的突变频率高于原发灶(3 vs 1)。在 3’-UTR区,常见的突变基因有XKR4, ANO5, FOXP2, CBL, CBLB, NTRK3, TRPM3, DACH2, 其中TRPM3和DACH2在转移灶中突变频率较高。作者发现XKR4基因3’-UTR 区突变与ANO5的突变相互排斥,他们分别是XKR8 和 ANO6的同源基因,可介导磷酯酰丝氨酸外化,构建免疫抑制肿瘤的微环境。同样CBL与其同源基因CBLB的3’-UTR区突变也相互排斥,而CBL与肿瘤的发生和转移有关。

肿瘤及其转移灶的基因组结构突变特征
基因组CNV研究结果显示转移灶与原发灶的CNV突变模式相似,见图3。除了TCGA队列中常见的CNV事件外, 该研究中还发现了6号染色体和16号染色体短臂(16p)上发生了扩增事件,在4号染色体短臂(4p)和5号染色体长臂(5q)以及8号染色体短臂(8p)上发生了缺失事件。其中,4号染色体扩增事件仅发生在原发灶中,而转移灶未发现。同时,9,11和Y染色体缺失多发生在转移灶中,2q, 10p, 13, 17, 21, X染色体扩增和15号染色体缺失则多发生在原发灶中。
基因组CNV研究结果显示转移灶与原发灶的CNV突变模式相似,见图3。除了TCGA队列中常见的CNV事件外, 该研究中还发现了6号染色体和16号染色体短臂(16p)上发生了扩增事件,在4号染色体短臂(4p)和5号染色体长臂(5q)以及8号染色体短臂(8p)上发生了缺失事件。其中,4号染色体扩增事件仅发生在原发灶中,而转移灶未发现。同时,9,11和Y染色体缺失多发生在转移灶中,2q, 10p, 13, 17, 21, X染色体扩增和15号染色体缺失则多发生在原发灶中。

另一方面,在基因组结构变异研究中发现,在5个样本中观察到了类减数分裂的染色体重排事件,其均带有TP53基因突变,其中某些基因组重排事件仅发生在原发灶中,见图3。SV重排事件中MACROD2是最常见的突变基因,其次是PDE11A, TTC28, FHIT, PARK2,分布在染色体脆性位点。TCGA数据库中常见的缺失基因RBFOX1,在该研究中只在少量原发灶样本检测到,表明在转移过程中该基因受到了负选择。在转移灶中鉴定出的高频SV事件,主要包含SAMD5, MACROD2, IGF2, AC007319.1基因;在原发灶中鉴定出的高频SV事件,主要包含ARHGEF18, IFNGR2, RBFOX1, SLIT3,TMEM50B, CTD-2374C24.1, RP11-6N13.1, RP11-420N3.2, CTD-2207O23.3和CTC-575N7.1基因。

CRC进展模型的扩展
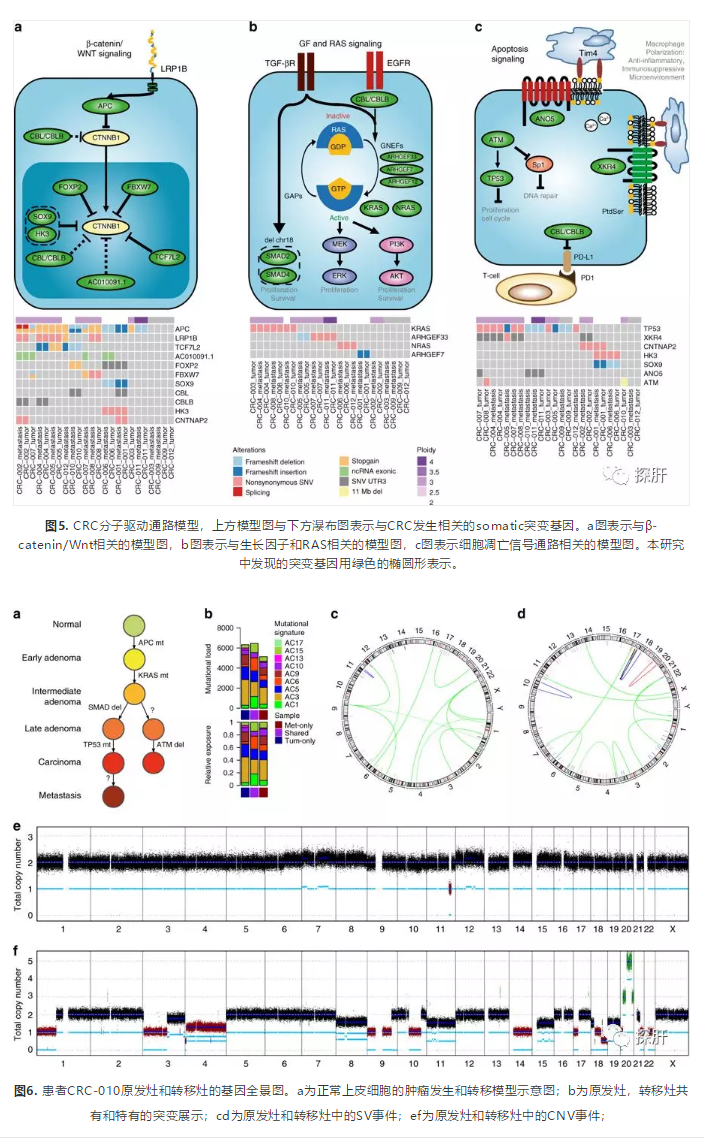
经典的CRC发生是循序渐进的,不断累积Wnt、RAS、TGF-β和p53信号通路上的突变。通过分析共发生和相互排斥的突变事件,可扩展CRC的发展模型。通过扩展的CRC进展模型,研究者在Wnt信号通路的负调控因子中发现很多冗余突变,约85%的高纯度肿瘤样本中至少含有3个这些负调控因子的突变。研究还发现KRAS, NRAS基因突变与ARHGEF33、ARHGEF7基因突变存在互斥性,表明ARHGEF33、ARHGEF7的突变与KRAS, NRAS基因突变在功能上可能发挥相同的作用(图5)。在TCGA队列的研究中发现,ARHGEF7基因的突变与较短的无病生存期显著相关(p-value 0.004)。在该研究中,NRAS与ARHGEF33基因突变仅发生在二倍体中,而KRAS与ARHGEF33基因突变主要发生在非整倍体和TP53突变的个体中。在该研究中未发现TGF-β信号通路上的高频突变,然而,却发现18号染色体上包含SMAD2和SMAD4基因的缺失(图4b),这种情况在此前肝癌研究中有所报道。并且,TP53基因突变主要与非整倍性相关(图4c)。另一发面,尽管大部分原发灶和转移灶中都含有TP53基因突变,但是患者CRC-010的原发灶中没有TP53突变,而发生了包含ATM基因(TP53的调控因子)在内的11Mb片段的缺失,该结果表明该患者体内可能存在两个相互独立的癌症触发机制(图6)。
经典的CRC发生是循序渐进的,不断累积Wnt、RAS、TGF-β和p53信号通路上的突变。通过分析共发生和相互排斥的突变事件,可扩展CRC的发展模型。通过扩展的CRC进展模型,研究者在Wnt信号通路的负调控因子中发现很多冗余突变,约85%的高纯度肿瘤样本中至少含有3个这些负调控因子的突变。研究还发现KRAS, NRAS基因突变与ARHGEF33、ARHGEF7基因突变存在互斥性,表明ARHGEF33、ARHGEF7的突变与KRAS, NRAS基因突变在功能上可能发挥相同的作用(图5)。在TCGA队列的研究中发现,ARHGEF7基因的突变与较短的无病生存期显著相关(p-value 0.004)。在该研究中,NRAS与ARHGEF33基因突变仅发生在二倍体中,而KRAS与ARHGEF33基因突变主要发生在非整倍体和TP53突变的个体中。在该研究中未发现TGF-β信号通路上的高频突变,然而,却发现18号染色体上包含SMAD2和SMAD4基因的缺失(图4b),这种情况在此前肝癌研究中有所报道。并且,TP53基因突变主要与非整倍性相关(图4c)。另一发面,尽管大部分原发灶和转移灶中都含有TP53基因突变,但是患者CRC-010的原发灶中没有TP53突变,而发生了包含ATM基因(TP53的调控因子)在内的11Mb片段的缺失,该结果表明该患者体内可能存在两个相互独立的癌症触发机制(图6)。
癌症进展中的突变特征
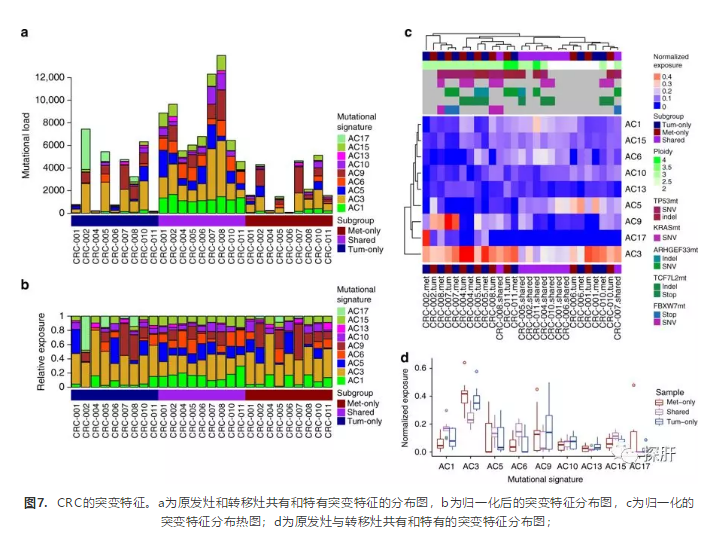
进一步研究癌症进展中的突变特征以确定其他可能预示疾病进展的模式,研究发现了AC1, AC3, AC5, AC6, AC9, AC10, AC13, AC15, AC17九个突变特征(图7ab)。AC1和AC5与年龄相关,AC3, AC6, AC15与DNA修复功能丧失相关,AC9与胞苷脱氨酶基因活性相关,AC10与聚合酶E功能相关,AC13与APOBEC酶家族的活性相关,与AC17相关的特征尚不清楚。聚类结果显示转移灶与原发灶具有共同的主克隆,转移灶分化出来后又发生了新的突变过程(图7cd)。
转移灶突变基因的功能及其临床相关性
研究中发现了48个转移灶特有的突变基因,其功能富集分析显示,这些转移灶特有的突变基因主要与细胞外基质、PI3K-Akt信号通路和粘附相关的通路相关。此外,转移灶中突变的基因多与肝纤维化/星状细胞和肌动蛋白骨架相关。
如果转移灶中的突变不同于原发灶,且具有临床治疗和决策意义,则将这些基因定义为具有临床相关性的基因突变。研究者利用TARGET和NCT-MASTER数据库鉴定每个患者原发灶和转移灶中相关事件,平均每个患者检测到9个突变(1-17个),大部分原发灶和转移灶的临床相关性突变相同。但是,在4个患者中,发现了转移灶特有的突变基因FAT1, FGF1, BRCA2,TP53, KDR,以及原发灶特有的JAK2。另一方面,通过对3’-UTRs区的突变研究发现,在3例病人中,AKT3 (CRC-002), PDGFRA, (CRC-005)和AKT2 (CRC-010)等临床关注基因的3’-UTRs区发生突变。
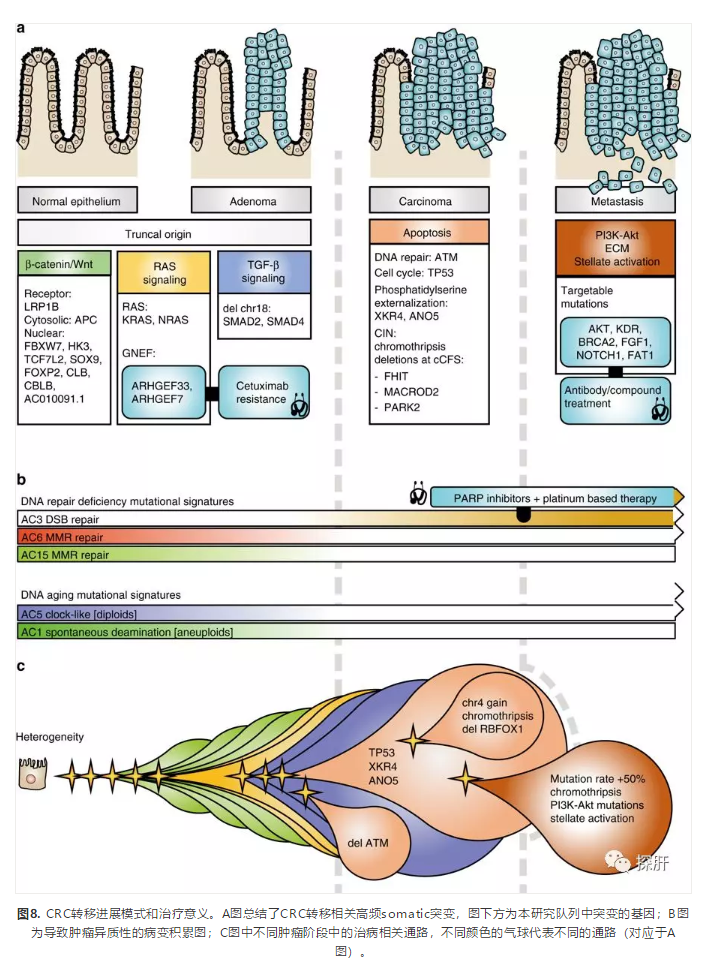
最终研究者发现,与CRC进展主线特征相比,DNA损伤修复功能缺陷相关的突变特征(AC3)在肿瘤以及转移特有的突变中显著减少,而与BRCA相关的突变特征增多,说明PARP抑制剂相关的治疗在CRC及其转移瘤中可能会发挥有效的治疗作用。通过上述在基因组层面对CRC及其转移灶的变异特征研究,作者构建了扩展的CRC进展模型,如图8所示。
研究中发现了48个转移灶特有的突变基因,其功能富集分析显示,这些转移灶特有的突变基因主要与细胞外基质、PI3K-Akt信号通路和粘附相关的通路相关。此外,转移灶中突变的基因多与肝纤维化/星状细胞和肌动蛋白骨架相关。
如果转移灶中的突变不同于原发灶,且具有临床治疗和决策意义,则将这些基因定义为具有临床相关性的基因突变。研究者利用TARGET和NCT-MASTER数据库鉴定每个患者原发灶和转移灶中相关事件,平均每个患者检测到9个突变(1-17个),大部分原发灶和转移灶的临床相关性突变相同。但是,在4个患者中,发现了转移灶特有的突变基因FAT1, FGF1, BRCA2,TP53, KDR,以及原发灶特有的JAK2。另一方面,通过对3’-UTRs区的突变研究发现,在3例病人中,AKT3 (CRC-002), PDGFRA, (CRC-005)和AKT2 (CRC-010)等临床关注基因的3’-UTRs区发生突变。
最终研究者发现,与CRC进展主线特征相比,DNA损伤修复功能缺陷相关的突变特征(AC3)在肿瘤以及转移特有的突变中显著减少,而与BRCA相关的突变特征增多,说明PARP抑制剂相关的治疗在CRC及其转移瘤中可能会发挥有效的治疗作用。通过上述在基因组层面对CRC及其转移灶的变异特征研究,作者构建了扩展的CRC进展模型,如图8所示。
总结
本文是迄今为止最全面的系统描述CRC原发灶和转移灶全基因组图谱差异的研究,并提出了肿瘤转移进化的假说,为肿瘤的发生发展和个体化治疗提供了证据支持和理论指导。但是,仍然需要更广泛的研究来证实该假说。
参考文献
1. Hoyer M, Erichsen R, Gandrup P, Norgaard M, Jacobsen JB. Survival in patients with synchronous liver metastases in central and northern Denmark, 1998 to 2009. Clin Epidemiol. 2011;3(Suppl 1):11–7.
2. Turdean S, Gurzu S, Turcu M, Void zan S, Sin A. Liver Metastases: Incidence and Clinicopathological Data. Acta Medica Marisiensis. 2012;58(4):254–8.
3. 中华医学会外科分会胃肠外科学组,中华医学会外科分会结直肠外科学组,中国抗癌协会大肠癌专业委员会等。中国结直肠癌肝转移诊断和综合治疗指南 (Ⅴ2018). 中华结直肠疾病电子杂志, 2018, 7(4): 302-314.
4. Ishaque N, Abba ML, Hauser C et al. Whole genome sequencing puts forward hypotheses on metastasis evolution and therapy in colorectal cancer. Nat Commun. 2018 Nov 14;9(1):4782.
本文是迄今为止最全面的系统描述CRC原发灶和转移灶全基因组图谱差异的研究,并提出了肿瘤转移进化的假说,为肿瘤的发生发展和个体化治疗提供了证据支持和理论指导。但是,仍然需要更广泛的研究来证实该假说。
参考文献
1. Hoyer M, Erichsen R, Gandrup P, Norgaard M, Jacobsen JB. Survival in patients with synchronous liver metastases in central and northern Denmark, 1998 to 2009. Clin Epidemiol. 2011;3(Suppl 1):11–7.
2. Turdean S, Gurzu S, Turcu M, Void zan S, Sin A. Liver Metastases: Incidence and Clinicopathological Data. Acta Medica Marisiensis. 2012;58(4):254–8.
3. 中华医学会外科分会胃肠外科学组,中华医学会外科分会结直肠外科学组,中国抗癌协会大肠癌专业委员会等。中国结直肠癌肝转移诊断和综合治疗指南 (Ⅴ2018). 中华结直肠疾病电子杂志, 2018, 7(4): 302-314.
4. Ishaque N, Abba ML, Hauser C et al. Whole genome sequencing puts forward hypotheses on metastasis evolution and therapy in colorectal cancer. Nat Commun. 2018 Nov 14;9(1):4782.
(声明:本网站部分图片、文章来源于网络,本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们联系,我们将及时删除)
