肝癌基因组测序研究总结
根据国际癌症研究机构(IARC)的数据,肝癌是全球致死率第三的癌症。到目前为止,在全球范围内已有数千个肝癌基因组进行了测序分析,在肝癌中已经发现了大多数的驱动基因/高频率突变,包括Wnt/β-联蛋白途径,TP53/细胞周期途径,端粒维持和染色质调节因子等。随着NGS技术在癌症研究中的应用,国际或国内癌症基因组研究已经陆续开展,用以有效促进癌症基因组测序并在科学家之间分享高质量数据,如国际癌症基因组联盟(ICGC)等。这些项目收集了具有不同流行病学(病毒和酒精)和种族(日本,中国,美国和法国)背景的样本测序数据,这些庞大数据集的整合,可更加的清晰理解肝癌的分子或遗传特征与流行病学、环境和种族因素之间的关系。目前,NGS技术作为癌症精准医疗,应用于临床测序,分析癌症相关的突变基因,并将具有特定突变的患者纳入临床试验。
本篇文章总结了最近的肝癌基因组测序研究,包括驱动基因发现,病毒整合和突变特征。基于这些测序数据,还讨论了肝癌精准医学的临床测序研究。
肝癌的全基因组/外显子组测序分析
通过外显子组和全基因组测序(WGS)对世界范围内的肝癌进行了许多全面的基因组测序研究。全外显子组测序(WES)可以有效地检测到人类基因组的全蛋白编码外显子(30-40 Mb,约为人类基因组的1-2%)突变。使用NGS进行测序分析的准确性,取决于目标区域的序列深度或覆盖度,WES通常可以覆盖超过80x的测序深度,WES可更准确检测到SNVs和段的插入片段。另一方面,全基因组测序(WGS)可以覆盖几乎所有的人类基因组序列(大约3 Gb)并可以检测到非编码区域中的突变,结构变异(SVs),拷贝数改变(CNAs)和病毒整合。全基因组测序(WGS)检测的更加综合全面,适用于分析癌症基因组的整体分析。随着NGS技术和信息学的发展,WGS的成本和劳动力正在迅速下降,它正在成为人类和癌症基因组分析的核心技术。
肝癌中突变的驱动基因
许多基因组研究试图阐明肝癌的分子变化情况。该方向的研究包含p53 /细胞周期途径(TP53和CDKN2A)和Wnt途径(CTNNB1和AXIN1),全基因组拷贝数分析还鉴定一些区域的扩增和缺失,如MYC和CCND1的扩增和CDKN2A的缺失区域。基于NGS的肝癌基因组测序研究可准确地识别体细胞突变基因(表见表1)
表1.肝癌体体细胞突变

Wnt/β-连环蛋白信号通路
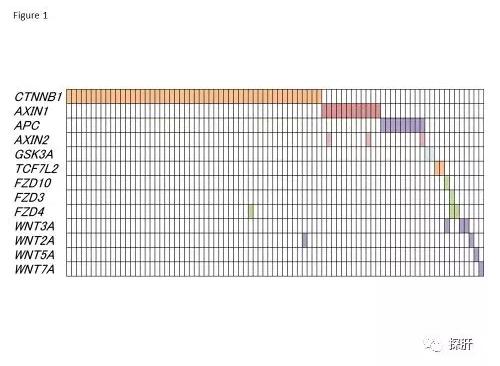
Wnt /β-连环蛋白途径通过调节细胞增殖,迁移和极性参与器官发育和肿瘤发生。在40-50%的肝癌中发现了该途径的分子突变。CTNNB1(β-连环蛋白)外显子3的点突变可以稳定 β-连环蛋白并将其转化为细胞核,反式激活下游的致癌分子,如Myc和CCND1(细胞周期蛋白D1)。AXIN1在降解β-连环蛋白以及APC和GSK3A中起关键作用,10%的HCC具有AXIN1突变。此外,Wnt /β-连环蛋白途径上游的其他分子,如Wnt配体和Wnt受体FZD以及下游的TCF7L2在少数HCC病例中发生突变,这些突变是相互排斥的(见下图)。
TP53和细胞周期通路
TP53在是基因组的“守护者”,维持基因组稳定性,在大多数类型的癌症中是。研究发现在30-40%的肝癌中发生了TP53突变,在由黄曲霉毒素暴露引起的肝癌中,密码子249(Arg> Ser)的特异性突变反复发生。IRF2蛋白通过其DNA结合活性和蛋白质-蛋白质相互作用起到转录调节因子作用。通过全外显子测序(WES)确发现,在5%的肝癌患者中检测到复发IRF2突变。IRF2和TP53突变以相互排斥的方式存在,并且TP53-野生型肝癌细胞系中IRF2的下调促进细胞增殖并降低p53蛋白水平,证实IRF2是新的肿瘤抑制因子并且涉及肝脏中的p53调节。
Ras / ERK途径
核糖体蛋白S6激酶(RPS6KA3)或RSK2编码Ras/MAPK信号传导途径的丝氨酸/苏氨酸激酶。它被细胞外调节的激酶1和2(ERK1/2)直接磷酸化和激活,并对Ras / ERK途径发挥反馈抑制作用。RPS6KA3通过p53和ATM的磷酸化影响p53介导的下游细胞事件以响应DNA损伤。在约10%的肝癌中发现了复发性的RPS6KA3突变,其中一半的突变导致过早终止密码子。这些突变可能导致ERK途径和TP53途径的异常激活。ERRFI1(ERBB受体反馈抑制剂1,MIG6)是EGFR家族的负调节因子,在10%的肝癌中观察到其突变和拷贝数丢失。
SWI/SNF染色质调节和表观遗传修饰因子
ARID2突变在HCV阳性肝癌中很常见。在大多数类型的肝癌中鉴定到复发性ARID1A和ARID2突变。据报道,ARID1A突变在与酒精摄入相关的肝癌中发生更加频繁,并且显示与CTNNB1突变显着相关。这些鉴定的突变包括多个indel和无义突变,表明它们的突变可导致功能的丧失。另外,在肝癌中已经鉴定了其它SWI/SNF亚基的罕见突变,包括共同亚基(SMARCA2,SMARCA4,SMARCB1),BAF亚基(SMARCA1)和PBAF亚基(PBRM1,BRD7)。SWI/SNF复合物通过改变染色质构象调节多种生物现象,包括DNA修复,干细胞编程和细胞迁移,这些复杂亚基的畸变可能对肝癌生物学产生广泛影响。肝癌细胞系中ARID家族基因的下调促进了细胞增殖,表明这些表观遗传修饰基因在肝癌中具有肿瘤抑制功能。HCC细胞系中的ARID2敲除导致DNA修复过程的破坏,导致对致癌物的易感性和潜在的突变。
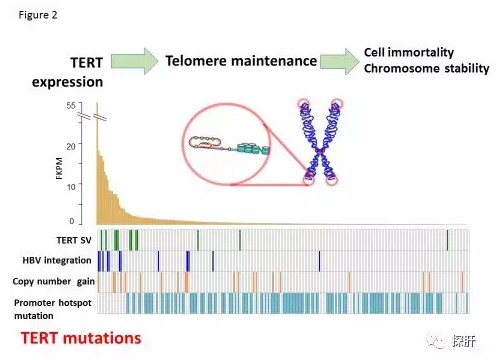
TERT和端粒维持
端粒酶可延长染色体末端的端粒DNA(TTAGGG重复序列),并维持肿瘤细胞的无限增殖和染色体稳定性。 TERT表达和端粒酶活性在大多数癌症中广泛存在且可检测到。在黑素瘤中报道了来自第一个ATG位点-124和-146bp的TERT核心启动子的复发突变。这些TERT热点启动子突变经常发生在HCC等肿瘤中,总体突变频率约为50-60%。肝癌发生的早期阶段,在肝硬化中观察到TERT启动子突变。此外,WGS分析显示SVs,HBV整合和CNA影响TERT的启动子或外显子1区域,这与TERT的高表达相关,即在启动子突变的情况下。其他端粒相关基因也在肝癌中发生突变,例如ATRX和NSMCE2。
其他驱动基因
肝脏是人体内代谢通路的中枢器官。在肝癌中经常观察到代谢相关基因的突变,其中高度突变的基因之一是其外显子和内含子中的白蛋白(ALB)和APOB。它们在肝细胞中的表达非常高,并且很可能在这些基因中被动地发生突变,因为它们的染色质结构是可持续开放的从而容易发生突变。 HNF1A和HNF4A是肝脏代谢途径和肝细胞分化的中心调节因子,它们经常发生突变并且功能丧失,导致肝细胞分化的破坏。肝细胞腺瘤(HCA)是良性肝肿瘤,可发展为HCC,HCA具有炎症信号通路(IL6ST,FRK,STAT3,JAK1)的激活,以及β-连环蛋白的激活突变特点。
肝癌中的结构变异(SV)和融合基因
WGS分析鉴定了肝癌基因组中的几种类型的结构变异(SVs)。这些结构变异影响了上述肝癌的驱动基因,如TERT,CDKN2A,APC ARID1A,以及一些新基因,如TTC28,MACROD2和LRP1B,结构变异可影响调节这些肝癌的驱动基因的表达。结构变异可以产生具有一定致癌能力的融合转录物,并且可作为分子疗法的靶点,例如肺癌中的ALK,MET,ROS。然而,除了10%的肝内胆管癌(ICCs)中的FGFR2融合转录物外,在常见类型的肝癌中没有发现复发性融合基因。
肝癌中的拷贝数变异
大片段DNA拷贝数改变(CNA)可导致癌基因的激活和癌症中肿瘤抑制基因的失活。通过传统技术方法在HCC中观察到染色体1,7,8和20的增加以及染色体4,8,13和17的丢失。肝癌中CNA相关癌基因和肿瘤抑制因子包括8q24.21(MYC),11q13.3(CCND1 / FGF3 / FGF4 / FGF19),19q12(CCNE1),7q31.2 ACCEPTED(MET),5p15的局灶性扩增。以及涉及13q14.2(RB1),9p21.3(CDKN2A)和10q23.31(PTEN)的局灶性缺失。
病毒整合
HBV是DNA病毒,其基因组包含约3K核苷酸的环状DNA。HBV整合可能发生在HBV感染的早期阶段,且HBV整合到宿主(人)基因组中可能是肝癌发生的第一步骤之一。NGS分析已经确定染色体5p15上的TERT区域是HBV整合的优选靶区域,并且HBV整合也发生在染色体19q13上的MLL4基因中。WGS对HBV整合位点进行最全面的分析表明,HBV整合事件在TERT,MLL4和CCN1位点反复发生。对一种HBV阳性肝癌及其非肿瘤肝组织的深度WGS分析表明,肝癌和非肿瘤肝组织中存在异质及广泛的病毒整合。这些研究结果表明,在HBV感染的早期阶段,HBV整合可以在每个肝细胞中随机发生,并且肝细胞凭借其HBV整合和随后的基因组改变而获得生长或存活优势,从而被选择或存活至单克隆扩增至瘤。
突变特征与病因的关联
癌症中的体细胞突变是多种突变过程的结果,包括DNA复制机制的错乱,外源或内源诱变剂的暴露,DNA的酶促修饰以及缺陷DNA修复。不同的突变过程产生突变类型的独特性,称为“突变特征”。每种突变特征模式以组织特异性方式与每种癌症病因相关联。例如,C>A/G>T颠换是由黄曲霉毒素暴露引起的肝癌中TP53基因中最常见的突变特征。肝癌的突变特征分析表明,几种突变特征可能与特定类型的癌症病因学相关。在肝癌中观察到的六个代表性突变特征(图3所示)。突变特征1代表时钟状突变过程(衰老)并且在所有类型的癌症中观察到。突变特征24代表与黄曲霉毒素相关的突变,突变特征4与吸烟接触有关,突变特征16可能代表酒精和乙醛的暴露。通过在已建立的癌症基因组中观察全基因组体细胞突变特征,可以推测其在肝癌的多种病因中的个体肝癌发展的病因学因素。

图3. 突变特征
肝癌的胆道表型,细胞来源和分子分类
肝胆管癌(ICC)和HCC是临床上不同的原发性肝癌,具有病因和生物学异质性。但罕见类型的肝癌显示HCC和ICC的混合表型或组合表型。肝脏中的多能祖细胞可以在肝再生期间分化成肝细胞和胆管细胞 ICC发展的主要风险因素之一是慢性肝炎和与病毒感染相关的肝硬化以及HCC。肝癌胆管表型的突变特征分析表明,ICC与肝炎的突变特征与HCC的突变特征相似,通过基因组和表观基因组学分析进一步分析ICC的细胞来源,表明ICC和HCC的共同细胞原始细胞。最近一些研究报道了ICC的突变情况,研究表明ICC和HCC之间存在一些突变,但有些突变是ICC独有的。对于HCC的分子分类,许多研究报告了基于体细胞突变谱,RNA表达谱和与患者预后相关的DNA甲基化谱的分子分类。总结为HCC可大致分为两种主要亚型:一种是细胞增殖信号和侵袭型信号。第二类是非增殖或正常肝细胞样类,其与Wnt途径的异常信号传导有关。
在肝癌和精准医疗中可操控的基因或突变
肝癌中突变情况总结如图4和表1。各种基因组突变的累积与肝癌的发展相关。遗憾的是肝癌基因组中没有那么多“可操作的”基因或突变。现在批准的肝癌药物有限,其他新的多激酶抑制剂正在进行肝癌的临床试验。他们的主要目标是调节血管生成的VEGFR2(血管内皮生长因子受体2)。在肝癌的研究发现其他“可操作”的基因或突变,如PIK3CA,TSC1/2,KIT和JAK1/2,尽管这些基因或突变在肝癌中的出现频率比较罕见的,且在临床试验水平上也还没有任何证据表明它们对这些靶标具有可操作性或分子疗法的效率。但是通过扩增这些“可操作”基因的研究表明,通过靶向EGFR,MET,BRAF或ERBB2的扩增,激酶抑制剂可能对20-30%的HCC患者有益。表1显示了突变基因在肝癌中的直接作用的总结。特别是在ICC中,IDH1/2突变和FGFR融合在5-10%的ICC中被检测为“可操作”的基因突变,并且它们正在临床试验中。使用免疫检查点抑制剂的免疫疗法已经在某些类型的癌症中显示出巨大的希望。
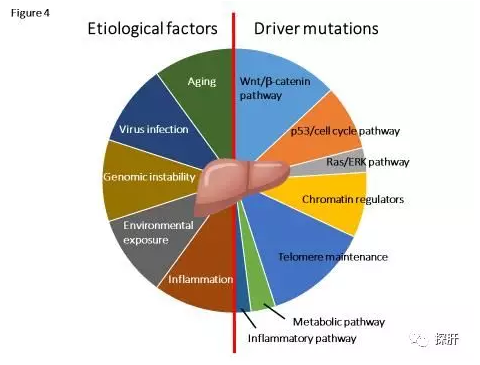
图4. 肝癌突变总览
总 结
在全球范围内已经有数千种肝癌基因组进行了测序,大多数驱动基因/高频率的突变在肝癌中已经确认,包括Wnt/β-连环蛋白途径,TP53/细胞周期途径,端粒维持和染色质调节因子等。肝癌的病因学是最容易理解的,并且肝癌的突变特征可以提供许多证据表明特定病因因素和突变特征之间的关联。对于精准医学而言,在肝癌中可“操作基因”或突变较少,所以到目前为止分子靶向治疗相对有限。但是通过测序获得的肝癌中罕见的突变可能作为指导其他特定的分子疗法的研究基础,将大量的基因组数据集与功能和其他组学数据集整合,将为肝癌治疗和精准医学提供新的视野。
参考文献:
Hidewaki Nakagawa et al .Genome Sequencing Analysis of Liver Cancer for Precision Medicine.Seminars in Cancer Biology.(2018)doi.org/10.1016/j.semcancer.
